
|
| |||
|
Разделы
Главная
Сапромат
Моделирование
Взаимодействие
Методы
Инновации
Индукция
Исследования
Факторизация
Частоты
Популярное
Как составляется проект слаботочных сетей?
Как защитить объект?
Слаботочные системы в проекте «Умный дом»
Какой дом надежнее: каркасный или брусовой?
Как правильно создавать слаботочные системы?
Что такое энергоэффективные дома?
|
Главная » Сегрегация Термодинамика поверхностной сегрегации ZrC из твердого раствора Zr1-xNbxC и фазовые равновесия в системе Zr - Nb - C Ремпель С. В., Гусев А. И. (gusev@ihim.uran.ru) Институт химии твердого тела УрО РАН, 620219 Екатеринбург, Россия В работе обсуждается поверхностная сегрегация карбида ZrC из твердых растворов (ZrC)1-x(NbC)x. Подобное явление в карбидных твердых растворах ранее не наблюдалось. Согласно [1-3] в системе Zr - Nb - C при T > 1273 K кубические карбиды циркония и ниобия образуют непрерывный ряд твердых растворов. Какие-либо экспериментальные результаты по фазовым равновесиям в системах Zr - Nb - C или ZrCy - NbCy при температуре ниже 1273 K отсутствуют. Из теоретических оценок [4] следует, что при T < 800 K в системе ZrC - NbC может существовать протяженная область распада. Для обнаружения распада были изучены твердые растворы (ZrC)1-x(NbC)x с 0.001 < (1 - x) < 0.05. Образцы синтезировали методом твердофазного вакуумного спекания из карбидов NbC и ZrC или же из Nb, Zr и C; в первом варианте максимальная температура спекания была 2500 K, во втором - 2300 K. Содержание основных элементов и примесей в исходных веществах определяли химическим и спектральным анализами. Все синтезированные твердые растворы однофазны и имеют кубическую структуру B1; период решетки aB1 = 0.44670+0.00002 нм в пределах ошибки измерений совпадает с периодом близкого к стехиометрии карбида ниобия [4]. Образцы синтезированных твердых растворов отжигали при температуре 2300 K в вакууме 10 Па в течение 1 ч и после этого быстро охлаждали до 1300 K со средней скоростью 200 K мин-1, а затем медленно до 600 K; общее время охлаждения составляло три часа. Рентгеновская дифракция поверхности отожженных образцов (ZrC)1-x(NbC)x с (1 - x) < 0.02, полученных из карбидов NbC и ZrC, показала, что после отжига наряду с отражениями карбидного твердого раствора с периодом aB1 = 0.44655 нм появились интенсивные линии другой фазы со структурой B1, имеющей период aB1 = 0.4698 нм, очень близкий к периоду решетки карбида циркония ZrC0.93-0.98, равному 0.4699 нм [4]. Судя по изменению периода решетки твердого раствора после отжига и по величине периода появившейся фазы, содержание NbC в отожженном твердом растворе составляет ~99 мол %, а ZrC - около 1 мол %. На поперечном срезе отожженных образцов видно, что на свободной поверхности появился плотный и более светлый, чем внутренняя часть образца, слой толщиной 0.1-0.2 мм. Рентгеновская дифракция поверхности отожженных образцов, синтезированных из Nb, Zr и C, обнаружила только линии фазы с периодом aB1 = 0.46986 нм, дифракционные отражения твердого раствора вообще отсутствуют. Электронная микроскопия отожженных твердых растворов (ZrC)1.x(NbC)x, синтезированных из карбидов, обнаружила на поверхности образцов хорошо ограненные выделения второй фазы, покрывающие до 50 % площади. Размер выделившихся зерен составляет 3-10 мкм (отдельные зерна до 20 мкм), размер зерен основной фазы около 1 мкм. Выделившиеся зерна имеют в основном форму трехгранников и шестигранников, характерную для сечения [111] кубических кристаллов. Поверхность отожженных образцов твердых растворов, синтезированных из Zr, Nb и C, полностью покрыта зернами выделившейся фазы. Химический состав выделившейся фазы определяли на рентгеновском микроанализаторе JFXA-733 Superprob. Изображение поверхности получено в обратно-отраженных электронах. Сканирование по поверхности с регистрацией характеристического излучения показало, что матрица образца содержит Nb, а выделившиеся зерна новой фазы содержат Zr при практическом отсутствии ниобия (рис. 1). Полуколичественный элементный анализ был выполнен с помощью лазерного энергомасс-анализатора ЭМАЛ-2. Масс-спектры, полученные с поверхности отожженных твердых растворов (ZrC)1-x(NbC)x, синтезированных из Zr, Nb и C, и масс-спектры внутренней части этих же образцов приведены на рис. 2. Основными компонентами вещества, испаренного с поверхности, полностью покрытой зернами выделившейся фазы, являются Zr и C, 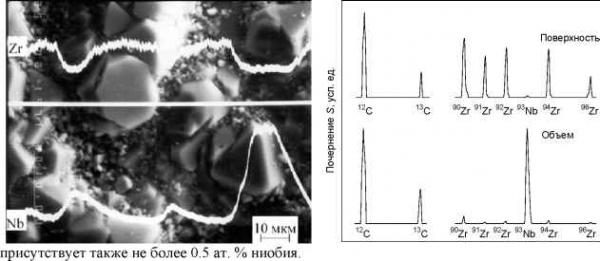 Рис. 1. Распределения интенсивностей Рис. 2. Масс-спектры поверхностной характеристического рентгеновского излучения выделившейся фазы и внутренней части циркония Zr и ниобия Nb при сканировании (основной фазы) отожженных образцов поверхности отожженного образца твердого (ZrC)0.02(NbC)0.98. Оптическая плотность раствора (ZrC)002(NbC)098 вдоль белой почернения Sj ~ lgc, где cj - концентрация горизонтальной линии. j-элемента (изотопа) в ат. %. Результаты рентгеновского микроанализа и лазерного масс-анализа в совокупности с данными электронной микроскопии и рентгеновской дифракции однозначно свидетельствуют о выделении зерен карбида циркония на поверхности образцов карбидного твердого раствора. Это выделение может быть следствием первоначальной негомогенности или распада твердых растворов. Ранее выполненные структурные исследования [5, 6] показали, что исходные твердые растворы гомогенны, поэтому появление второй фазы после отжига связано с распадом твердых растворов. Для выяснения положения области распада на фазовой диаграмме псевдобинарной системы ZrCy - NbCy мы рассчитали фазовые равновесия в этой системе при температуре ниже 1300 K. Помимо области распада были рассчитаны фазовые равновесия и положение поверхности ликвидуса в тройной системе Zr - Nb - C, частью которой является псевдобинарная система ZrCy - NbCy. Расчеты были выполнены в модели субрегулярных растворов [4]. Для расчета твердофазного распада нужно знать только энергию взаимообмена Bs = B0s + xB1s в твердой фазе. Параметры B0s и B1s энергий взаимообмена твердой фазы нескольких псевдобинарных сечений ZrCy - NbCy, использованные для расчета области распада, приведены в таблице. Таблица Параметры B0s и B1s энергии взаимообмена Bs = B0s + xB1s твердой фазы для некоторых псевдобинарных сечений карбидных твердых растворов (ZrCy)1-x(NbCy)x
Карбиды циркония и ниобия являются нестехиометрическими соединениями; при высокой температуре (T > 1400-1500 K) их равновесным состоянием является неупорядоченное, но при температуре ниже 1300 K в этих карбидах могут происходить структурные фазовые переходы беспорядок-порядок и образование различных упорядоченных фаз. Поэтому фазовые равновесия в двойных карбидообразующих системах Zr - C и Nb - C, ограничивающих тройную систему Zr - Nb - C, рассчитывали с учетом упорядочения нестехиометрических карбидов ZrCy и NbCy; для расчета этих фазовых равновесий использовали метод функционала параметров порядка [7, 8]. Фазовая диаграмма двойной системы Zr - Nb построена с использованием экспериментальных [9-12] и теоретических [13-15] данных. Общий вид рассчитанной фазовой диаграммы системы Zr - Nb - C в интервале температур 300-3900 K приведен на рис. 3. T, K 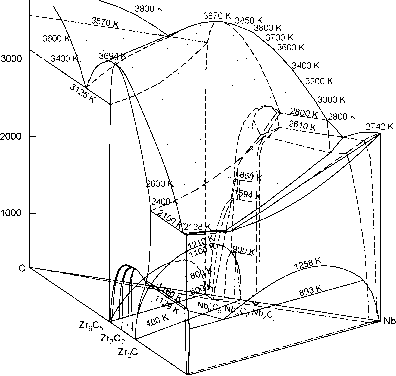 Рис. 3. Фазовая диаграмма тройной системы Zr - Nb - C в интервале температур 300-3900 K и изотермические сечения поверхностей ликвидуса и твердофазной области распада: Zr2C, Zr3C2 и Zr6C5 - упорядоченные фазы карбида циркония ZrCy; Nb3C2 и Nb6C5 -упорядоченные фазы карбида ниобия NbCy; Nb2Cy - низший гексагональный карбид ниобия Согласно проведенному расчету, при T > 1200 K карбиды ZrCy и NbCy с любым содержанием углерода в пределах областей гомогенности кубических фаз образуют непрерывный ряд твердых растворов, но при меньшей температуре в этой системе существует скрытая область распада в твердом состоянии (рис. 3). Изотермические сечения поверхности области распада показаны на рис. 4. Максимальная температура распада твердых растворов растет при уменьшении содержания углерода: от Т™2 = 843 K для сечения ZiClo - NdClo до 1210 K для сечения ZrC0.60 - NbCa70 (при содержании 57.2 мол. % карбида NbC070). Асимметричность области распада и смещение ее вершины в псевдобинарных разрезах ZrCy - NbCy в сторону карбида ниобия NbCy (66.8 мол. % NbCy при y = 1.00 и 56.3 мол. % NbCy при y = 0.70) означают, что при температуре Т < Tdecomp растворимость ZrCy в карбиде ниобия в несколько раз меньше, чем растворимость NbCy в карбиде циркония ZrCy. 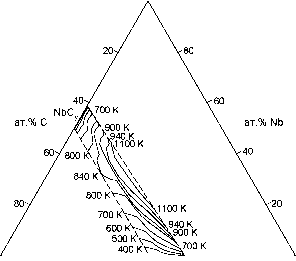 с 1 1 ZrC-1 1 zr 20 40 Cy 60 80 ат.% Zr Рис. 4. Проекция изотермических сечений поверхности скрытой области распада твердых растворов Zr1-xNbxCy на тройную фазовую диаграмму Zr - Nb - C Таким образом, термодинамический расчет подтверждает существование низкотемпературной области распада твердых растворов системы ZrCy - NbCy. Но само по себе наличие области распада является только необходимым, но не достаточным условием поверхностной сегрегации. Действительно, исследование внутренней части образцов показало, что она является однофазной. Это позволяет сделать некоторые предположения о механизме распада растворов (ZrC)1-x(NbC)x при малом содержании карбида циркония. Диффузионный распад твердых растворов может осуществляться двумя механизмами [16]. Первый из них - спинодальный распад, который происходит во всем объеме раствора без образования зародышей новой фазы и при непрерывном (без скачка) уменьшении свободной энергии системы. Второй механизм - флуктуационное зарождение фаз и последующий их рост. Спинодальный распад не реализуется, по-видимому, из-за низкой температуры, при которой диффузионная подвижность атомов в кристалле слишком мала для того, чтобы фаза с преимущественным содержанием карбида ниобия и циркониевая фаза, содержащая только ZrC, разделились в пространстве. При флуктуационном зародышеобразовании рост зерен новой фазы в поверхностном слое облегчен благодаря положительной роли энергии границ раздела [16], поэтому образование циркониевой фазы становится возможным при относительно низкой температуре. Поверхность твердофазной системы при высокой температуре может обогащаться компонентом, который имеет более высокое парциальное давление паров. Однако в системе ZrCy - NbCy выделение карбида ZrC наблюдается при низкой температуре T < 1000 K, а испарение карбидов циркония и ниобия уже при T < 1800 K экспериментально не обнаружимо, так как скорость испарения V - 0. Кроме того, для карбидов ZrC и NbC при температуре T < 2073 K парциальное давление Zr меньше, чем парциальное давление Nb [4]. Обогащение поверхности твердофазной системы легким компонентом может быть результатом гравитационного разделения ( всплывания ). Однако изотопный состав циркония в выделившемся карбиде ZrC совпал с обычным изотопным составом циркония, т. е. обогащения легкими изотопами 91Zr и 92Zr не произошло, а содержание наиболее тяжелого изотопа 96Zr не уменьшилось. Это означает, что выделение ZrC на свободной поверхности образцов (ZrC)1-x(NbC)x не является следствием гравитационного разделения. Сегрегация второй фазы возможна, если ее содержание превышает предел растворимости. Расчеты границ области несмешиваемости показали, что при T < 700 K твердые растворы (ZrC)1-x(NbC)x с (1 - x) > 0.01 являются пересыщенными по содержанию ZrC. Таким образом, в твердых растворах (ZrC)1-x(NbC)x с содержанием ZrC ~ 1 мол. % и более необходимое условие сегрегации выполняется при T < 700 K. Достаточные условия поверхностной сегрегации связаны с энергией сегрегации и с диффузией. Если компоненты A и B системы A - B есть растворенное вещество и растворитель, соответственно, то в системе ZrCy - NbCy растворителем является карбид ниобия, а растворенным веществом - карбид циркония, т. е. A = ZrCy и B = NbCy. Согласно модели равновесного состояния поверхности твердых растворов [17-19] для системы A - B атомную концентрацию растворенного вещества xA-surf в поверхностной фазе можно найти как xA-surf xB-surf (xA-bulk /xB-bulk)exp(-A#seg/£B7) , (1) где xA; B-bulk - атомное содержание растворенного вещества и растворителя в объемной фазе; xB-surf = 1 - xA-surf; A seg - энергия сегрегации растворенного вещества A. Оценка по формуле (1) энергии поверхностной сегрегации ZrC с учетом значений xZrC-surf ~ 0.985, xZrC-bulk ~ 0.013 и Т = 700 K дает AHseg-exp ~ -50 кДж-моль-1. Согласно [18, 19], энергия AHseg включает в себя энергию межфазных границ AHint, энергию парных межатомных взаимодействий AHbin и деформационную энергию AHdef, т.е. A#seg = A#int + AHbin + A#def. Энергия границ раздела определяется как AFint = (ya - YB)sbNa , (2) где уА; в - удельные энергии границ раздела растворенного вещества A и растворителя B; sB = (M/pNA)2/3 - площадь поверхности, приходящаяся на одну молекулу растворителя; M и р -молекулярная масса и плотность растворителя. Для ZrC и NbC при Т = 1773 K уА = YZrC = 2.13 и ув = YNbC = 2.60 Дж-м-2, соответственно [20]; для INiClo sB = 0.0793 нм2. С учетом этого в системе ZrC - NbC энергия AHint -22.4 кДж-моль-1. Найденная величина AHint -грубая оценка, так как для карбидов точность определения энергий у мала и составляет ±40 Вклад энергии парных межатомных взаимодействий в случае твердого раствора можно представить как AHbin = - G/(zxA-bulkxB-bulk), где G- избыточная энергия смешения, z - координационное число решетки. В твердой фазе Ge = xАxBBs, где Bs - энергия взаимообмена [4, 8], поэтому AHbin = - Bs / z. Для твердых растворах ZrCy - NbCy с ГЦК металлической подрешеткой z = 6, энергия взаимообмена Bs в твердой фазе составляет примерно -15 кДж-моль-1 [8], поэтому энергия AHbin -2.5 кДж-моль-1. Деформационная энергия AHdef обусловлена разницей размеров замещаемых атомов и ее можно представить [19, 21] через упругие модули как AHdef = -24;Na[KaGbRaRb(Ra - Rb)2]/(4GbRb + 3KaRa) , (3) где КА - модуль всестороннего сжатия растворенного вещества; GB - модуль сдвига растворителя; Raj B - эффективные атомные (ионные) радиусы взаимозамещаемых атомов растворителя и растворенного вещества. Для ионов Nb5+ и Zr4+ с координационным числом z = 6 RNb = 0.064 нм и RZr = 0.072 нм; упругие модули GNbC = 2.20Х1011 Па и KZrC = 2.28Х1011 Па. Для этих значений R, G и К деформационная энергия (3) твердых растворов ZrCy - NbCy равна AHdef -6.4 кДж-моль-1. Теоретическое значение энергии сегрегации карбида циркония из твердого раствора ZrCy - NbCy с учетом найденных вкладов AHint, AHbin и AHdef равно AHseg -31.3 кДж-моль-1 и отличается от экспериментальной оценки AHseg-exp ~ -50 кДж-моль-1. Заниженная абсолютная величина теоретической энергии AHseg обусловлена малой точностью оценки энергии границ раздела AHint, которая вносит основной вклад в энергию сегрегации AHseg. Если D - коэффициент диффузии растворенного вещества A при температуре T, xA-surf(0 и xA-surf - содержание вещества A на поверхности в момент времени t и при достижении равновесия, то, используя уравнение диффузии, предложенное авторами [22], можно получить [6] уравнение диффузии для случая, когда на поверхности выделяется новая фаза и а = xA-surf/xA-bulk >> 1, можно записать в виде xA -su rf(t) = xB-surf (xA-bulk/xB-bulk)exp(-AHseg/feT){1 - exp(Dt/a2 J2)erfc[(Dt/a2 d2)1/2]}. (4) где d - толщина поверхностного слоя новой фазы; а = const - максимальная величина коэффициента обогащения поверхности растворенным веществом A при t - оо. Функция erfc(x) = 1 - erf(x) = = j exp(-x2)dx есть дополнительный интеграл вероятности. При t - оо и в отсутствие испарения содержание сегреганта асимптотически приближается к равновесному значению xA-surf = xB-surf(xA-bulk/xB-bulk)exp(-AHseg/B7), которое зависит лишь от состава твердого раствора и энергии сегрегации. При температуре 500-700 K в твердом растворе (ZrC)001(NbC)099 с энергией сегрегации AHseg = -31.3 кДж-моль-1 величина равновесной (при t - оо) концентрации ZrC в поверхностной фазе, xZrC-surf, оцененная по формуле (5), составляет от ~0.80 до ~0.98. Это достаточно близко к экспериментальной величине, которая составляет не менее 0.97. Интересно, что сегрегацию атомов циркония на поверхности аналогичной металлической системы Zr - Nb, не содержащей углерода, наблюдали в работе [23]; заметим, что система Zr - Nb, как и псевдобинарная система ZrCy - NbCy, имеет разрыв смешиваемости в твердом состоянии. Таким образом, наблюдается подобие фазовых равновесий в твердых растворах систем Zr - Nb и ZrCy - NbCy. В целом проведенное экспериментальное и теоретическое изучение карбидных цирконий-ниобиевых твердых растворов ZrCy - NbCy и сопоставление их с твердыми растворами системы Zr - Nb показывает, что низкотемпературные фазовые равновесия в этих системах подобны. Это дает основания полагать, что явление распада карбидных цирконий-ниобиевых твердых растворов и, в частности, поверхностная сегрегация ZrC из разбавленных твердых растворов генетически связаны с распадом и поверхностной сегрегацией металлических растворов системы Zr - Nb. Это означает, что в процессе распада карбидных цирконий-ниобиевых твердых растворов существенная роль принадлежит взаимодействиям в металлической подрешетке. Расчеты с применением модели субрегулярных растворов и метода функционала параметров порядка позволили построить фазовую диаграмму тройной системы Zr - Nb -C. Они показали, что в этой системе при температуре выше 1210 K образуются неограниченные твердые растворы кубических карбидов циркония и ниобия, а при Т < 1200 K существует скрытая область распада карбидных растворов (ZrCy)1-x(NbCy)x. Это согласуется с экспериментальными данными по поверхностной сегрегации карбида ZrCy на поверхности разбавленного карбидного твердого раствора (ZrC)1-x(NbC)x с 0.001 < (1 - x) < 0.05. Литература 1. P. Stecher, F. Benesovsky, A. Neckel, H. Nowotny. Monatsh. Chemie 95, 6, 1630 (1964). 2. Т. Ф. Федоров, Н. М. Попова, Ю. И. Гладышевский. Изв. АН СССР. Металлы 3, 158 (1965). (Engl. Transl.: Russ. Metallurgy 3, 72 (1965)). 3. Т. Ф. Федоров, Ю. И. Гладышевский. Порошковая металлургия 1, 37 (1965). (Engl. Transl.: Sov. Powder Metallurgy and Metal Ceramics 1, 27 (1965)). 4. 4 А. И. Гусев. Физическая химия нестехиометрических тугоплавких соединений. М.: Наука (1991). 286 c. 5. 5. А. А. Ремпель, С. В. Ремпель, А. И. Гусев. Докл. РАН 369, 4, 486 (1999). 6. С. В. Ремпель, А. И. Гусев. ФТТ 44, 1, 66 (2002). 7. А. И. Гусев. УФН 170, 1, 3 (2000). 8. A. I. Gusev, A. A. Rempel, A. J. Magerl. Disorder and Order in Strongly Nonstoichiometric Compounds. Transition Metal Carbides, Nitrides and Oxides. Berlin-Heidelberg-New York: Springer (2001). 607 pp. 9. A. G. Knapton. J. Less-Common Metals 2, 2, 113 (1960). 10. P. Van Effenterre. Rapport CEA-R-4330. Commissariat a lEnergie Atomique. Saclay (France): Centre dEtudes Nucleaires de Saclay. 1972. 62 pp. 11. P. E. J. Flewitt. J. Appl. Crystallogr. 5, 6, 423 (1972). 12. P. E. J. Flewitt. Acta Metall. 22, 1, 47 (1974). 13. J. P. Abriata, J. C. Bolcich. Bull. Alloy Phase Diagrams 3, 1, 34 (1982). 14. A. F. Guilermet. Z. Metallkunde 82, 6, 478 (1991). 15. K. S. Hari Kumar, P. Wollants, L. Delaey. J. Alloy Comp. 206, 1-2, 121 (1994). 16. В. В. Слезов, В. В. Сагалович. УФН 151, 1, 67 (1987). 17. R. Defay, I. Prigogine, A. Bellemans, D. H. Everett. Surface Tension and Adsorption. New York (Wiley & Sons) 1966. P.158. 18. P. Wynblatt, R. C. Ku. Surf. Sci. 65, 2, 511 (1977). 19. R. C. McCune, P. Wynblatt. J. Amer. Ceram. Soc. 66, 2, 111 (1983). 20. R. Warren. J. Mater. Sci. 15, 10, 2489 (1980). 21. J. Friedel. Adv. Phys. 3, 12, 446 (1954). 22. C. Lea, M. P. Seah. Philosoph. Mag. 35, 1, 213 (1977). 23. И. Бурибаев, Н. Талипов, Н. А. Нурманов Н.А. Изв. АН СССР. Серия физическая 55, 12, 2340 (1991). | ||||||||||||||||||||||||||||||||||||||||||||||||||
|
| |||