
|
| |||
|
Разделы
Главная
Сапромат
Моделирование
Взаимодействие
Методы
Инновации
Индукция
Исследования
Факторизация
Частоты
Популярное
Как составляется проект слаботочных сетей?
Как защитить объект?
Слаботочные системы в проекте «Умный дом»
Какой дом надежнее: каркасный или брусовой?
Как правильно создавать слаботочные системы?
Что такое энергоэффективные дома?
|
Главная » Исследование Исследование химических коммуникаций у доминантных видов биоты солоноватого озера Шира (Хакасия) в лабораторных условиях Губанов М.В. (guban@ibp.ru) Институт биофизики СО РАН, Красноярск Введение Вертикальное распределение зоопланктона, его суточные вертикальные миграции играют большую роль в функционировании морских и континентальных водоемов. Формирование вертикальной структуры зоопланктона происходит под действием комплекса абиотических и биотических факторов среды. Вертикальная структура сообщества складывается как результирующая суточных и сезонных миграций. Вертикальное распределение с одной стороны является интегральной характеристикой, отражающей состояние водоема, а с другой является одним из регуляторов потока вещества и энергии в экосистеме. Одним из факторов, определяющих феномен вертикальных миграций, являются колебания освещенности (Заика и др., 1976). Ламперт и Луз (Lampert, 1993; Loose, 1993) продемонстрировали, что для многих видов зоопланктона суточные вертикальные миграции вероятнее всего связаны с избеганием в светлое время хищников. В этом случае, суточные вертикальные миграции индуцируются двумя регулирующими факторами -интенсивностью света и химическими сигналами от хищников (Larsson, Dodson, 1993; Reingelberg, 1999). Имеется большое количество данных, иллюстрирующих действенность химических сигналов хищников на вертикальное распределение их жертв в лабораторных условиях (Dodson, 1988; Dawidowicz et al., 1990; Loose et al., 1993). Работы по исследованию суточной динамики вертикальной структуры некоторых массовых видов зоопланктона в солоноватом меромектическом озере Шира (Россия, Хакасия, максимальная глубина 22 м) показали, что копеподы Arctodiaptomus salinus и коловратки Brachionus plicatilis обладают закономерно изменяющимся в течение суток стратифицированным вертикальным распределением. В дневные часы они отходят от поверхности, а в темное время суток, наоборот, стремятся к ней (Zotina et al., 1999). Лабораторное исследование питания бокоплава Gammarus lacustris показало, что ювенильные особи G.lacustris потребляют коловраток, а взрослые особи потребляют веслоногих рачков A.salinus (Yemelyanova et al., 2002). То есть, по данным этих авторов копеподы A.salinus могут быть частью пищевого рациона бокоплавов, а G.lacustris в таком случае единственный вид, который является потенциальным хищником для A.salinus, потому что в озере Шира полностью отсутствуют рыба и другие возможные хищники. Наши лабораторные исследования показали, что продукты жизнедеятельности G.lacustris достоверно влияют на вертикальное распределение A.salinus в лабораторных условиях. При этом эффективность действия воды-скоплений на вертикальное распределение A.salinus тем выше, чем выше плотность посадки G.lacustris при приготовлении воды-скоплений (Zadereev, Gubanov, 2002). Однако у экспериментов с водой скоплений есть и свои недочеты (Задереев, 2002). Для приготовления воды скоплений затрачивается длительный промежуток времени, в течение которого в среде происходит накопление всех типов продуктов жизнедеятельности (как видоспецифичных, так и невидоспецифичных) в повышенных концентрациях. Неизвестны как скорость и интенсивность выделения продуктов жизнедеятельности, так и скорость их распада. Метаболизм животных, используемых для производства продуктов жизнедеятельности, может быть нарушен вследствие слишком плотной посадки на стадии приготовления воды-скоплений, что влечет за собой изменение спектра выделяемых веществ. Кроме того, в экспериментах с водой скоплений химические вещества, вызывающие наблюдаемые эффекты, присутствуют во всем экспериментальном объеме, то есть отсутствует градиент (неоднородность) их концентрации. В результате, интерпретация данных, полученных с использованием вышеописанной методики, не всегда однозначна. Учитывая все вышесказанное, с целью дальнейшего исследования химических взаимодействий между A.salinus и G.lacustris и оценки роли этих взаимодействий в формировании вертикального распределения зоопланктона в озере Шира были поставлены следующие задачи: А) в лабораторных условиях исследовать вертикальное распределение A.salinus при неоднородном распределении химических веществ, ассоциирующихся с G.lacustris и его жертвой A.salinus. Б) получить и сравнить вертикальные профили распределения A.salinus и G.lacustris в озере Шира. Материал и методы исследования Исследование вертикального распределения A.salinus проводилось в вертикальных стеклянных квадратных сосудах (высота - 60 см, ширина боковой стенки - 5 см, объем среды 1,3 литра). Эксперименты проводились в термостате, где поддерживалась температура 17-19оС. Во всех экспериментах для оценки вертикального распределения A.salinus стаканы были разделены на 5 одинаковых вертикальных слоев. Определение количества рачков в каждом слое производилось визуально. Средняя глубина залегания популяции ( d ) определялась как: - 5 i n d = х -, i=1 n где: i - номер слоя, ni - количество рачков в i - слое, n - общее количество рачков. В экспериментах для заполнения экспериментальных стаканов использовалась озерная вода с глубины 3 метра с пелагиали озера (станция над глубиной 16 м) пропущенная через мелкий газ №76. Диаптомус для экспериментов отбирался сачком (площадь сачка = 0.44 м2, размер ячейки = 160 мкм) вертикальным тралом с глубины 3 метра до поверхности. Гаммарус для экспериментов отлавливался у берега. Во время проведения всех экспериментов в экспериментальные стаканы вносился A.salinus в количестве 45 - 50 особей на один стакан. Визуальные наблюдения и регистрация вертикального распределения производились через регулярные промежутки времени. Первое наблюдение производилось через час после начала эксперимента, затем каждые полчаса - в течение 4 - 5 часов. Всего десять наблюдений в каждом эксперименте. Для создания направленного воздействия на вертикальное распределение A.salinus в опытные сосуды помещались: 1) закрытые стаканчики (диаметр - 2 см, длина - 7 см) из крупного газа (0.25 мм) с заключенным в них живым G.lacustris (4 особи/стаканчик). 2) пустые закрытые стаканчики (диаметр - 2 см, длина - 7 см) из крупного газа (0.25 мм). 3) стеклянные сосуды объемом 5 миллилитров с гомогенатом A.salinus закрытые сверху мелким газом №76. 4) стеклянные сосуды объемом 5 миллилитров с гомогенатом G.lacustris закрытые сверху мелким газом №76. 5) электродвигатели для создания гидродинамического возмущения воды в верхнем (первом) слое опытных экспериментальных стаканов. Скорость вращения лопастей электродвигателей равнялась 9 оборотов в минуту. Для создания гомогената A.salinus использовались рачки и озерная вода с глубины 3 метра. Всех рачков A.salinus, содержащихся в 800 мл воды, сгущали на газ (до состояния густой красной пасты), помещали в ступку, растирали и затем смешивали с озерной воды (5 мл). Для создания гомогената G.lacustris также использовалась озерная вода с глубины 3 метра. Трех рачков G.lacustris помещали в ступку, растирали и смешивали с озерной воды (5 мл). В качестве контроля выступали сосуды, в которых A.salinus не испытывал никакого воздействия. С использованием вышеописанной методики были проведены две серии экспериментов: а) при освещении, б) в темноте. При освещении были выполнены следующие независимые эксперименты: 1. Контроль, опыт (в нижнем пятом слое помещен стаканчик с заключенным в нем живым G.lacustris). 2. Контроль, опыт (в верхнем первом слое помещен стаканчик с заключенным в нем живым G.lacustris). 3. Контроль (в верхнем первом слое создаются гидродинамические возмущения), опыт (в верхнем первом слое создаются гидродинамические возмущения и в нижнем пятом слое помещен стаканчик с живым G.lacustris). 4. Контроль, опыт (в нижнем пятом слое помещен сосуд объемом 5 миллилитров с гомогенатом из G.lacustris). 5. Контроль, опыт (в нижнем пятом слое помещен сосуд объемом 5 миллилитров с гомогенатом из A.salinus). В темноте были выполнены следующие независимые эксперименты: 1. Контроль, опыт (в нижнем пятом слое помещен стаканчик с живым G.lacustris). 2. Контроль, опыт (в нижнем пятом слое помещен сосуд объемом 5 миллилитров с гомогенатом из G.lacustris). 3. Два типа воздействий: а) в нижнем пятом слое помещен сосуд объемом 5 миллилитров с гомогенатом из A.salinus, б) в верхнем первом слое создаются гидродинамические возмущения и в нижнем пятом слое помещен стаканчик с живым G.lacustris. 4. Два типа воздействий: а) в верхнем первом слое создаются гидродинамические возмущения, б) в верхнем первом слое помещен стаканчик с живым G.lacustris. Визуальные наблюдения и регистрация вертикального распределения в экспериментах выполненных в темноте производилась при свете красной лампы. Во всех независимых экспериментах каждое воздействие и контроль были протестированы в трех повторностях. Достоверность различия между опытом и контролем во всех проведенных экспериментах оценивалась непараметрическим критерием Манна-Уитни в программе STATISTICA. Для оценки вертикального распределения G.lacustris в пелагиали озера пробы отбирали планктонной сетью (диаметр захвата 0.44 м2, размер ячейки 160 мкм) вертикальным тралом послойно с глубины до поверхности с интервалом 4 метра (последовательно облавливались слои 0-4 м, 0-8 м, 0-12 м, 0-16 м). Отбор проб G.lacustris производился над глубиной 18 метров на расстоянии 500м от берега в течение трех дней в трех повторностях каждый день. Весь объем отфильтровывали через сеть с размером ячеек 75мкм и концентрировали в пробе объемом 50 мл. Пробы фиксировали 70% спиртом. Пробы просчитывали под световым бинокуляром при увеличении х32. Сырую массу тела G.lacustris подсчитывали по уравнению, связывающему линейные размеры тела и вес животных: W = 0.086*l213, где, W - сырая масса (мг), l - абсолютная длинна тела (мм) (Емельянова, 2003). Для оценки вертикального распределения A.salinus пробы отбирали в слое 0-15 м с интервалом в один метр. С каждого горизонта отбирали по 3 литра батометром Молчанова. Весь объем отфильтровывали через сеть с размером ячеек 75мкм и концентрировали в пробе объемом 10 мл. Пробы фиксировали 70% спиртом с добавлением 5% глицерина. Пробы просчитывали под световым бинокуляром при увеличении х32 в камере Богорова. В популяции A.salinus выделяли науплиусов, копеподитные стадии С1-С3 (0,50-0,75 мм), С4-С5 (0,80-1,00 мм), самцов и самок. Сырую биомассу A.salinus подсчитывали по формулам, связывающим линейные размеры тела и вес животных (Общие основы .. .,1979). Результаты и обсуждение Несмотря на то, что среда (озерная вода) и животные для всех экспериментов отбирались с одной глубины и одной станции, не удалось добиться строгой повторяемости средней глубины залегания A.salinus в контрольных сосудах в разных экспериментах (Рис. 1, 2). Сравнение ранговым тестом Краскела-Уоллиса данных независимых контрольных экспериментов, проведенных на свету, показало достоверное отличие (H (3, N= 120) = 47.48268; P = 0.0000). Это можно объяснить следующим. Лабораторные эксперименты по исследованию вертикального распределения A.salinus проводились в условиях полевого стационара в течение 25 дней. Для каждого из независимых экспериментов тестируемая группа животных и среда (озерная вода) отбирались из озера непосредственно перед экспериментом. Таким образом, среда, используемая в экспериментах, концентрация корма, физиологическое состояние, возрастной и половой состав тестируемых животных могли отличаться в каждом независимом эксперименте, вследствие естественной динамики этих показателей в озере в течение периода исследований. В этом случае, статистическое сравнение различных экспериментов между собой затруднено. Основной анализ результатов будет выполнен на основе анализа результатов каждого отдельно взятого эксперимента. В экспериментах проведенных при освещении практически все протестированные воздействия оказали значимое влияние на вертикальное распределение A.salinus (Рис.1, Табл. 1). При помещении на дно опытных сосудов объемов с заключенным в них живым G.lacustris копеподы отреагировали поднятием в верхние слои. Точно такая же реакция A.salinus зафиксирована и в случае, когда в верхнем первом слое опытных сосудов создавались гидродинамические возмущения, а в нижнем пятом слое были помещены объемы с живым G.lacustris. И в этом эксперименте A.salinus располагался выше, чем в контрольном эксперименте. Противоположная картина зафиксирована в том случае, когда объемы с живым G.lacustris помещались вверху опытных сосудов. В этом случае A.salinus оставался на уровне группы тестируемых животных в контрольных сосудах. При помещении на дно опытных сосудов гомогенатов как G.lacustris, так и A.salinus диаптомус поднимался в верхние слои. А о к Б В Г Д о к о к о к о к Ч 2.: U 0 0.5 1 1.5 3.5 И 4 4.5 Рис. 1. Вертикальное распределение A.salinus в экспериментах выполненных при освещении. А - живой G.lacustris внизу, Б - живой G.lacustris вверху, В - живой G.lacustris внизу + гидродинамические возмущения вверху, Г - гомогенат G.lacustris внизу, Д - гомогенат A.salinus внизу. О - опыт, К - контроль. Результаты экспериментов выполненных в темноте представлены на Рис. 2. При помещении на дно опытных сосудов объемов с заключенным в них живым G.lacustris диаптомус отреагировал поднятием в верхние слои. Точно такая же реакция A.salinus зафиксирована и в случае, когда в верхнем первом слое опытных сосудов создаются гидродинамические возмущения, а в нижнем пятом слое находятся объемы с живым G.lacustris. Необходимо отметить, что параллельно с этим воздействием не проводился адекватный контрольный эксперимент. Однако, средняя глубина расположения группы рачков в этом случае (Рис. 2в/д) достоверно отличается как от двух независимых контрольных экспериментов (Рис. 2а, г), так и от независимого эксперимента, в котором в верхнем первом слое опытных сосудов создавалось гидродинамическое возмущение (Рис. 2б/в). При помещении в верхние слои опытных сосудов объемов с заключенным в них живым G.lacustris диаптомус расположился в нижних слоях сосудов. Сравнение этого эксперимента (Рис. 2б/в) с независимыми контрольными экспериментами (Рис. 2а, г) показывает, что копеподы расположены в одном случае выше, а в другом ниже рачков в контроле. В случае помещения на дно опытных сосудов гомогенатов G.lacustris, диаптомус в экспериментальных сосудах располагается выше, чем в контрольных. У эксперимента с расположенным на дне опытного сосуда объемом с гомогенатом A.salinus не было контроля. Средняя глубина расположения A.salinus в этом эксперименте (Рис. 2в/д) отличается только от одного из контрольных экспериментов (Рис. 2а, г). В/Д Б/В Рис. 2. Вертикальное распределение A.salinus в экспериментах выполненных в темноте. А - живой G.lacustris внизу, Г - гомогенат G.lacustris внизу, В/Д - живой G.lacustris внизу + гидродинамические возмущения вверху, гомогенат A.salinus внизу, Б/В - живой G.lacustris вверху, гидродинамические возмущения вверху. О - опыт, К - контроль. 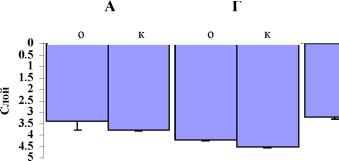 Из экспериментов, выполненных как при освещении, так и в темноте видно, что A.salinus реагирует на присутствие объема с G.lacustris внизу подъемом в верхние слои сосуда. Известно, что копеподы очень чувствительны к гидродинамическим возмущениям. Можно предположить, что заключенные в небольшой объем G.lacustris сталкиваясь со стенками сосуда, являются источником гидродинамических возмущений вызывающих реакцию подъема вверх у копепод. Для проверки этого предположения нами и был проведен эксперимент с созданием гидродинамических возмущений сверху. Однако в наших экспериментах гидродинамические возмущения не повлияли на результаты эксперимента. Несмотря на наличие гидродинамических возмущений вверху, A.salinus демонстрировал реакцию ухода вверх от заключенного в объеме из газа G.lacustris. По всей видимости, на A.salinus влияют химические вещества выделяемые G.lacustris. Сходное изменение в вертикальном распределении A.salinus наблюдали и в экспериментах с использованием воды скоплений (Zadereev, Gubanov, 2002). Присутствие химических взаимодействий между G.lacustris и A.salinus подтверждается в экспериментах, где в качестве воздействия на A.salinus выступают гомогенаты G.lacustris и A.salinus. Необходимо отметить, что при сравнении результатов экспериментов, с одинаковыми воздействиями, зафиксировано достоверное различие в средней глубине залегания A.salinus в темноте по сравнению с освещением. Средняя глубина залегания в темноте больше, чем при освещении, то есть располагается ниже (Табл. 1). Из проведенных экспериментов видно, что реакция A.salinus при освещении и в темноте на присутствие гомогенатов в опытных сосудах различается. В экспериментах на свету A.salinus реагирует на присутствие гомогенатов более сильным поднятием в верхние слои, по сравнению с такими же экспериментами проведенными в темноте. При этом, присутствие живого G.lacustris в нижнем 5-м слое опытного сосуда оказывает сходное воздействие на вертикальное распределение A.salinus как при освещении, так и в темноте. Можно предположить, что характер химических взаимоотношений G.lacustris и A.salinus складывается по схеме хищник - жертва . Реакция ухода A.salinus от G.lacustris является реакцией на присутствие хищника развитой в процессе эволюции. A.salinus вероятно реагирует на присутствие хищника и через химические вещества присутствующие в составе гомогенатов, поскольку гомогенаты являются аналогом поврежденных рачков в процессе их потребления. Таким образом, A.salinus, скорее всего, может реагировать не только на G.lacustris, но и на присутствие любого другого хищника. Отсюда можно предположить, что агенты химических коммуникаций, которые определяют характер реакции A.salinus на присутствие хищника являются не видоспецифичными. Таблица 1. Результаты исследования взаимодействий между G.lacustris (Crustacea, Amphipoda) и A.salinus (Crustacea, Copepoda)
d - средняя глубина популяции A.salinus (слой), Ad - доверительный интервал, P - уровень значимости, ГДВ - гидродинамические возмущения. То, что зафиксированные в лаборатории химические взаимоотношения между G.lacustris и A.salinus могут оказывать влияние на вертикальное распределение G.lacustris и A.salinus в какой-то мере подтверждается в пелагиали озера (Рис. 5). В зоне термоклина на глубине 5 - 6 метров у A.salinus наблюдается минимум, а у G.lacustris максимум биомассы. То есть, максимумы биомассы обоих видов частично разнесены в пространстве. А Б 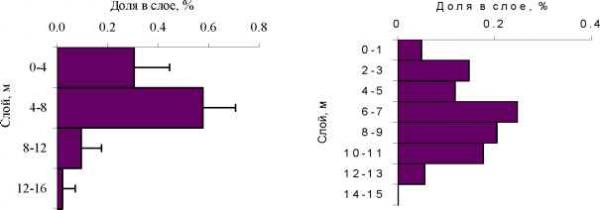 Рис. 5. Вертикальное распределение в пелагиали озера Шира. А - G.lacustris, Б - A.salinus; август 2002 и 2003 гг. 2 3 2 3 Средняя сырая биомасса G.lacustris - 5.9 г/м , 0.37 г/м , A.salinus - 12.9 г/м , 0.86 г/м . Таким образом, проведенные эксперименты показали, что в числе факторов, определяющих вертикальное распределение A.salinus, несомненно, являются химические коммуникационные агенты (вещества), продуцируемые G.lacustris и A.salinus. Как следствие этого, можно утверждать наличие химических взаимодействий у зоопланктона озера Шира. Характер химических взаимоотношений G.lacustris и A.salinus складывается по схеме хищник - жертва . Есть основания полагать, что химические агенты (вещества) определяющие характер реакции A.salinus на присутствие хищника не являются видоспецифичными. Литература 1. Емельянова А.Ю. Некоторые аспекты экологии и питания бокоплава Gammarus lacustris Sars из озера Шира (Хакасия). - Дис. канд.биол.наук. - Борок, 2003, 133 с. 2. Задереев Е.С. Химические взаимодействия среди планктонных ракообразных Журнал общей биологии. 2002. Т. 63: № 2 .С. 159-167. 3. Заика В.Е., Моряков В.К., Островская Н.А.. и др. Распределение морского микрозоопланктона. Киев: Наук. думка. 1976. 92с. 4. Общие основы изучения водных экосистем. / Под ред. Г.Г. Винберга. Л.: Наука, 1979. 273с. 5. Dawidowicz P, Pijanowska J and Ciechomski K (1990) Vertical migration of Chaoborus larvae is induced by the presence of fish. Limnol Oceanogr 35: 1631-1637. 6. Dodson S (1988) The ecological role of chemical stimuli for the zooplankton: predator-avoidance behavior in Daphnia. Limnol Oceanogr 33: 1431-1439. 7. Lampert W (1993) Ultimate causes of diel vertical migration of zooplankton: new evidence for the predator-avoidance hypothesis. Arch Hydrobiol Beih Ergebn Limnol 39: 79-88. 8. Larsson P and Dodson S (1993) Chemical communication in planktonic animals. Arch Hydrobiol 129: 129-155. 9. Loose CJ (1993) Daphnia diel vertical migration behavior: response to vertebrate predator abundance. Arch Hydrobiol Beih Ergebn Limnol 39: 29-36. 10. Loose CJ, von Elert E and Dawidowicz P (1993) Chemically-induced diel vertical migration in Daphnia: a new bioassay for kairomones excluded by fish. Arch Hydrobiol 126: 329-337. 11. Ringelberg J (1999) The photobehavior of Daphnia spp. as a model to explain diel vertical migration in Zooplankton. Biol Rev Cambridge Phil Soc 74: 397-423. 12. Yemelianova AY, Temerova TA and Degermendzhy AG (2002) Distribution of Gammarus lacustris Sars (Amphipoda, Gammaridae) in Lake Shira (Khakasia, Siberia) and laboratory study of its growth characteristics. Aquat Ecol 36: 245-256. 13. Zadereev YS and Gubanov MV (2002) The effect of chemicals released by Gammarus lacustris on the depth distribution of Arctodiaptomus salinus in laboratory conditions. Aquat Ecol 36: 257-260. 14. Zotina TA, Tolomeev AP and Degermendzhy NN (1999) Lake Shira, a Siberian salt lake: ecosystem structure and function. 1: Major physico-chemical and biological features. Int J Salt Lake Res 8: 211-232. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| |||